| Главная » Статьи » Мысли вслух, обзоры и пр. ... |
|
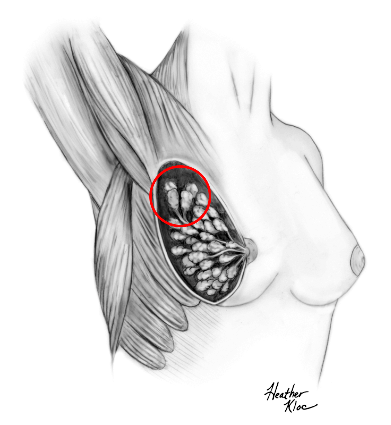
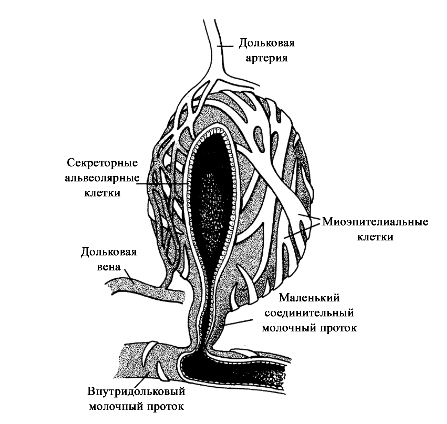
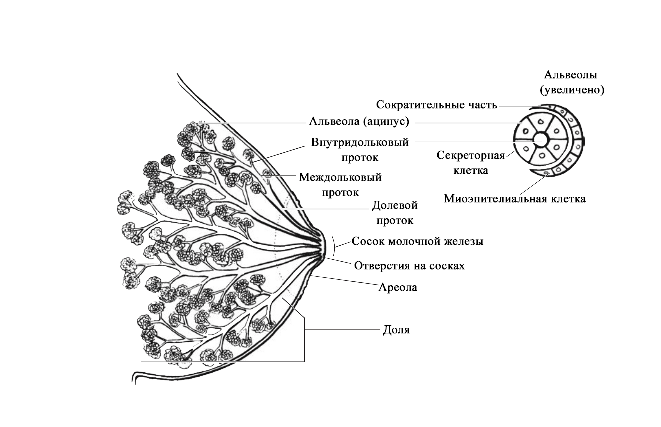
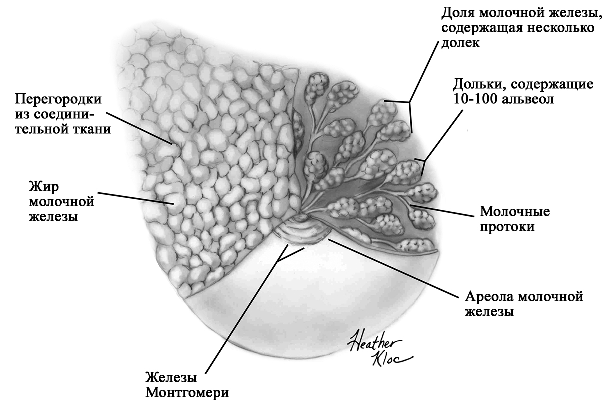
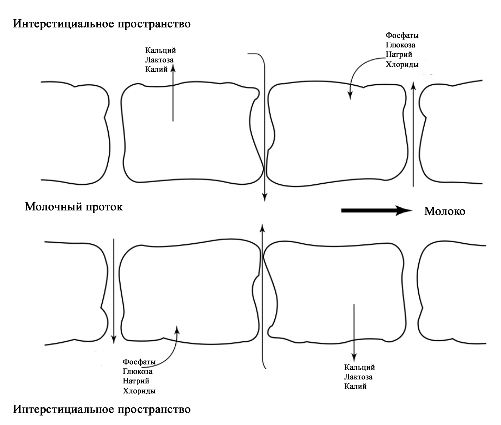
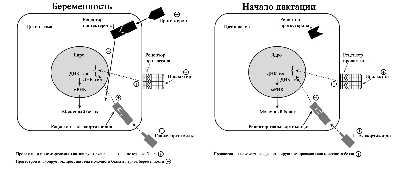
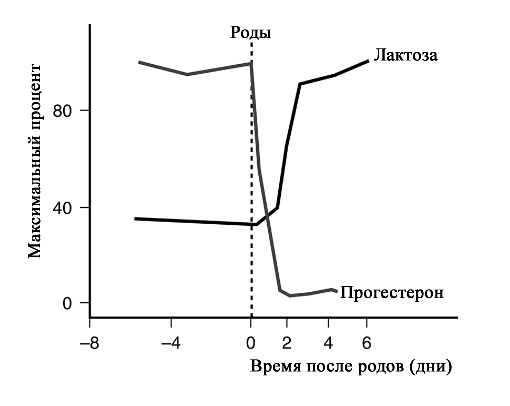
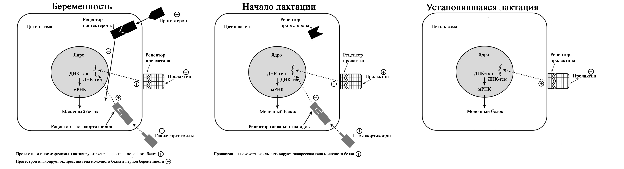
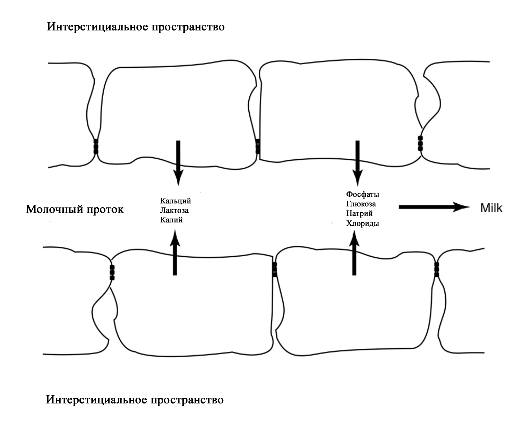
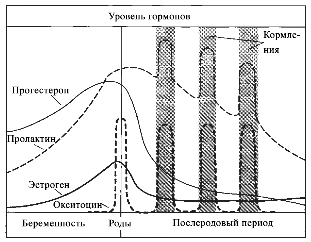
©2019 Яковлев Я.Я. До того, как обсуждать какие-либо проблемы лактации и решение их, необходимо знать, КАК весь ЭТОТ процесс происходит. Поэтому прежде всего необходимо вспомнить анатомию и физиологию лактации. Современные методы исследования позволяют точнее и глубже понять эти процессы. В данной статье предлагаю ознакомиться с обзором литературы по анатомии и физиологии лактации, список которой можно найти в библиографии. На картинки можно нажимать для увеличения размеров. Анатомия молочной железы (лат. mamma или glandula mammaria). У человека только молочные железы испытывают столь значительные и резкие изменения размера, формы и функции с рождения до беременности, в период лактации и в конечном итоге инволюции. Большое значение имеет влияние генов. Железа достигает полной зрелости только при наступлении беременности. Беременность и кормление грудью способствуют возникновению постоянных изменений, которые обеспечивают защитный эффект против рака молочной железы. Цикл развития молочной железы включает пять фаз: маммогенез, лактогенез I (секреторная дифференцировка), лактогенез II (секреторная активация), лактогенез III (лактация, галактопоэз) и лактогенез IV (инволюция) [1–3]. Стадии лактации [1; 2]. Развитие молочных желез начинается с 4-5 недель беременности и продолжается практически весь внутриутробный период развития [1; 2]. В исследованиях было показаны морфологические изменения в молочной железе плода, похожие на изменения в молочной железе матери, в ответ на гормональное влияние. Прошедшие через плаценту гормоны матери способствуют росту и развитию протоков железы у ребенка [1; 2]. При рождении эти же гормоны способствуют секреции напоминающей молоко жидкости (так называемое «молоко новорожденных», «молоко ведьм»), причем как у мальчиков, так и у девочек. В течение 3-4 недель такая активность стихает, и молочные железы находятся в «неактивном» состояние до периода полового созревания [2; 4]. В период полового развития происходит быстрый рост груди за счет установления менструальной функции. В этот период происходит развитие протоков, долей и окружающей их жировой ткани. Эстрогены, пролактин, лютеинизирующий, фолликулостимулирующий гормоны и гормон роста оказывают влияние на развитие груди у девушки в возрасте 10-12 лет. Первичные и вторичные молочные протоки растут и делятся, образуя связанные с началом функции гипоталамо-гипофизарно-яичниковой оси булавовидные концевые «почки». Эти «почки» развиваются в новые ветви и небольшие канальцы «почек» ареолы, которые впоследствии становятся ацинусами или альвеолами в зрелой женской груди, также известные как терминальная дуктоло-лобулярная единица [5]. После появления менструального цикла в груди происходят изменения, которые соответствуют определенной его фазе. Во время каждого овуляторного цикла под воздействием гормонов ткани молочной железы развиваются и в дальнейшем не регрессирует в прежнее состояние предыдущего цикла [4; 6]. Развитие новых структурных элементов молочных желез продолжается примерно до 35 лет [3; 6; 7]. Полное развитие функции молочных желез происходит только во время беременности [1]. Размер молочных желез формируется в период полового созревания до их взрослых параметров. Левая железа чаще немного больше правой [2; 8]. Вне беременности масса молочной железы в среднем 150-200 г, в период беременности масса увеличивается и к родам составляет в среднем от 400 до 600 г. Во время лактации – 600-800 г [1; 2]. Примерно между 6 и 9 месяцем лактации размер груди немного уменьшается. При этом молока образуется достаточно либо за счет мобилизации жировой ткани, либо за счет большей эффективности выработки молока тканями [9]. Размер и форма молочной железы зависят от генетических, расовых, диетических факторов [2; 10]. Ткани молочной железы у 2-6% женщин могут достигать подмышечных областей [1; 2; 11]. Этот участок железистой ткани называется «хвостом Спенса», описанный шотландским хирургом James Spence. Поскольку он сообщается с основными протоками молочной железы (фактически это часть молочной железы), то во время лактации может быть заметно увеличение данной области [11]. «Хвост Спенса»[2; 12]. Молочные железы в норме у женщины всегда парные и располагаются на так называемых «молочных линиях», которые развиваются в течение пятой недели эмбриональной жизни [13]. У некоторых женщин (4-6%) именно по этим «молочным линиям» остаются ткани молочной железы, что приводит к появлению дополнительных желез, который имеют железистую ткань, ареолу и сосок [2; 14]. Существуют врожденные и приобретенные аномалии молочных желез, о которых можно прочитать в соответствующих источниках. Расположение дополнительных молочных желез (в [2] по Weatherly-White R.C.A.: Plastic surgery of the female breast, Hagerstown, Md., 1980, Harper & Row). Молочная железа представляет собой «конгломерат» различного количества желез. Она претерпевает изменения, которые можно разделить на фазы развития и дифференцировки. Функциональная ткань молочной железы представлена комплексом протоки-дольки-альвеолы. Основной единицей зрелой железистой ткани являются альвеолы, состоящие из секреторных ацинарных клеток, в которых завершаются протоки. Каждый кластер секреторных клеток альвеол окружен миоэпителиальными клетками, ответственными за выведение молока в молочные протоки и являющимися сократительной единицей альвеол [1; 2; 15–17]. Молоко непрерывно секретируется и находится в просвете альвеол до тех пор, пока миоэпителиальные клетки его не выведут в протоки [3]. Структура альвеолы молочной железы. В [2] по [6] Vorherr H: The breast: morphology, physiology and lactation, New York, 1974, Academic Press с изменениями. В лактирующей железе альвеолы представляют собой полые мешочки, заполненные секретом. Стенка мешочка образована одним слоем железистых клеток – лактоцитов. Характерная особенность лактоцитов – наличие у них внутриклеточных секреторных канальцев, по которым белок молока (казеин) перемешается в просвет альвеолы. Альвеолы открываются в млечные альвеолярные ходы. Стенка ходов тоже образована одним слоем лактоцитов, но секреторная активность последних существенно меньше, чем у лактоцитов альвеол [16; 17]. От альвеол отходят внутридольковые протоки, выводящие молоко. Они объединяются без связи с соседними в междольковые протоки, которые в свою очередь сливаются в общий проток каждой доли [1; 2; 15–17]. Эти протоки сплетаются хаотично так же, как корни деревьев [1]. Долевые протоки направляются к соску, немного расширяясь. Некоторые из них сливаются. В концевой части они сужены и открываются на соске в виде млечных отверстий, которых обычно насчитывается около 8-15 [1; 2; 16; 17]. Часть (по данным Astley Cooper до 7-12[18]) протоков заканчиваются слепо в области соска. Молочные протоки небольшие, поверхностные, легко сдавливаются и увеличиваются в диаметре при выведении молока. Молочные протоки не расширяются в области ареолы в синусы, как считалось раньше [1, 2, 18, 19.]. Анатомия молочной железы. По [1] с изменениями. В каждой железе содержится 15–25 отдельных долей, которые разделены прослойками жировой и соединительной тканей [1; 2; 11; 16; 17]. Жировой компонент, который может составлять до половины объема груди, определяет форму молочной железы, и в него погружены все структуры. Жировой слой обеспечивает возможность роста и развития клеток молочной железы, обеспечивая пространство, поддержку и регуляцию этих процессов [1; 2]. Количество жировой ткани не влияет на емкость груди и выработку молока [20]. Каждая доля состоит из 20-40 долек, а долька – из 10-100 альвеол [1; 2; 15–17]. Ткани молочной железы поддерживаются связкой Купера, которую впервые описал Astley Cooper в 1840 году [18]. При растяжении этой связки, она не восстанавливает свой первоначальный размер [1; 18]. На коже груди находятся сосок и ареола. Кожа содержит волоски, сальные и потовых желез. Сосок молочной железы расположен в центре ареолы. Соски и ареолы женщин и мужчин качественно идентичны, хотя имеют разные размеры. Сосок содержит гладкие мышечные волокна и богато иннервируется чувствительными нервными окончаниями [2; 21]. Сосок окружен округлой пигментированной областью – ареолой. Структура кожи в этой области менее сложна, чем на соске [2]. Вокруг ареолы могут быть волоски. Сосок и ареола содержат эректильные мышечные волокна. При сокращение этих волокон сосок становится упругим и выпуклым [1]. Анатомия молочной железы. По [2] с изменениями. На ареоле находятся бугорки Монтгомери, в которые открываются сальные и выделяющие молоко железы. Эти образования называются железами Монтгомери (описаны в 1837 году ирландским акушером W. F. Montgomery) [22]. Железы Монтгомери выделяют вещество, которое смазывает и защищает соски и ареол во время беременности и лактации. Из них может секретироваться небольшое количество молока. В период беременности они увеличиваются в размерах. После окончания кормления грудью железы Монтгомери возвращают к своему исходному размеру [1; 2; 23]. Число этих образований у женщин варьирует – по данным разных автором их количество от 0 до 48 [1]. Их количество, одинаковое с обеих сторон, связано с размерами ареолы. Больше желез Монтгомери находится в верхней и боковой областях груди, куда чаще направлен нос ребенка при сосании из груди. Каждая пятая женщина сообщала, что видела жидкость, вытекающую из этих желез [24; 25]. По данным Schaal et al., 2006 у женщин с большим количеством желез Монтгомери дети лучше прибавляли в первые дни после рождения, быстрее присасывались к груди, активнее сосали и быстрее устанавливался лактогенез [25]. Кроме того, отмечалось, что младенцы у первородящих женщин с меньшим количеством желез Монтгомери теряли больше массу тела в течение первых трех дней жизни [24]. На основании этих данных были сделаны выводы, что железы Монтгомери являются органами, имеющими запах, выделяющие жидкость, что обеспечивает новорожденному сенсорную стимуляцию, направляет его к соскам, за счет чего стимулирует потребление большего количества молозива и, в конечном счете, увеличивает шансы на выживание [1]. В среднем размер ареолы у кормящих составляет 6,4 см. Размер ареолы значительно увеличивается в первые несколько дней после родов. Диаметр соска увеличивается во время беременности, приблизительно от 9-5 мм до 11,3 мм. Но сосок не может быть измерен точно, поскольку он изменяется в зависимости от степени эрекции. Wilson-Clay и Hoover, 2013 отметили, что женщины с очень большими сосками, возможно, имеют больше проблем при грудном вскармливании, в частности, низкое количество молока, предположительно связанных с проблемами прикладывания [1]. Размеры, форма, цвет и расположение молочных желез на грудной клетке различны у разных женщин – на это влияют гены. Размеры долек так же варьируют в пределах одной груди у одной женщины. Левая грудь чаще больше правой. Цвет ареол и сосков различаются в зависимости от оттенка кожи: розовые у блондинок, коричневые у брюнеток и черные у темнокожих женщин [1]. В молочной железе имеется большое количество кровеносных и лимфатических сосудов. Иннервируют молочную железу межреберные нервы (от 2 до 6 межреберья). Четвертый межреберный нерв проходит непосредственно до соска и определяет наибольшую чувствительность ареолы и соска, которая не является одинаковой во всех областях. Так ареола является наиболее чувствительной частью груди; кожа, прилегающая к ареоле, менее чувствительна; сам сосок имеет наименьшую чувствительность [1]. Женщины с большими молочными железами сообщают о меньшей чувствительности, чем женщины с небольшой грудью. Среди женин, у которых не было ни одной беременности, с грудью маленького или среднего размера отмечается большая чувствительность сосков и ареол. Четвертый межреберный нерв на середине расстояния до ареолы и соска становится поверхностным. В области ареолы он делится на пять веточек, повреждение которых может вести к потере чувствительности части или даже все области ареолы [26; 27]. Во время беременности грудь увеличивается, кожа на ней выглядит тоньше, а вены становятся более заметными. Диаметр ареолы увеличивается примерно от 34 мм в ранние сроки беременности до 50 мм после родов [28]. Постепенно соски становятся более упругими и выпуклыми. Увеличиваются пигментация сосков и размеры желез Монтгомери. Гормоны в крови стимулируют рост груди в период беременности: рост соска связан с уровнем пролактина, на рост ареолы влияет плацентарный лактоген [29]. Под влиянием эстрогенов происходит пролиферация и дифференцировка молочных протоков. Прогестерон способствует увеличению размеров долей, долек и альвеол. Адренокортикотропный гормон и гормон роста действуют синергично с пролактином и прогестероном, способствуя росту молочных желез [1]. Рост и дифференцировка древовидной системы протоков и дальнейшее формирование долей происходят в первой половине беременности. Во второй половине беременности усиливается секреторная активность, альвеолы накапливают молоко [в [1] по Russo & Russo, 1987]. После 16 недели это происходит даже тогда, когда беременность не развивается дальше [ [6] и в [1] по Salazar & Tobon, 1974]. Развитие тканей молочной железы для возможности секретировать молоко проходит с середины до поздних сроков беременности и называется I этапом лактогенеза или просто лактогенез I. В этот период (секреторной дифференцировки) происходит увеличение размеров груди, эпителиальные клетки альвеол дифференцируются в секреторные клетки для продукции молока. Жировые капли накапливаются в этих клетках и в плазме повышается концентрация лактозы и α-лактальбумина. Молочные капли перемещаются через клеточную мембрану в молочные протоки [0]. Ключевую роль в развитии и функционировании молочной железы играет апоптоз – регулируемый процесс программируемой клеточной гибели, в результате которого клетка распадается на отдельные тельца, ограниченные плазматической мембраной – который начинается еще при внутриутробной закладке молочной железы. После окончания кормления этот механизм удаляет избыток эпителиальных клеток для подготовки к будущей беременности. Этот же механизма играет свою роль в развития рака молочной железы [2; 30]. Инволюция молочной железы представляет собой процесс удаления производящих молоко клеток, когда они становятся ненужными после отъема от груди. Этот двухступенчатый процесс включает в себя смерть секреторного эпителия и замена его жировыми клетками. Удивительная способность груди производить молоко сочетается с механизмом апоптоза – формы программированной гибели клеток [31]. Физиология лактации. Лактация является физиологическим завершением репродуктивного цикла. Закладка тканей молочной железы происходит внутриутробно. В дальнейшем в течение всей жизни у женщины происходят изменения в ней, которые связаны с возрастом, менструальным циклом, беременностью и лактацией. Активную роль в этом играют эндокринная и нервные системы. Молочная железа претерпевает изменения в течение всей жизни женщины – в детском, подростковом возрастах и во взрослом состоянии. В период беременности молочная железа развивается и «готовится» стать основным источником питания младенца [2]. Гормональный контроль лактации осуществляется в течение всех пяти основных этапов развития молочной железы: маммогенеза (включая эмбриогенез), лактогенеза I (секреторная дифференцировка), лактогенеза II (секреторная активация), лактогенеза III (лактация, галактопоэз) и лактогенеза IV (инволюция) [1–3]. В первые месяцы беременности продолжается маммогенез, который характеризуется увеличением молочных желез за счет пролиферации дуктоло-альвеолярной структуры. Маммогенез в период беременности постепенно переходит в инициацию лактации (лактогенез I и II). Инициация лактации включает в себя две фазы: секреторную дифференцировку и секреторную активацию [2; 32; 33]. Секреторная дифференцировка связана с развитием тканей молочной железы, что создает условия для секреции молока. Примерно с 12-16 недель беременность до её поздних сроков грудь «готовится» к лактации без какого-либо вмешательства женщины. Этот период называется I этапом лактогенеза или просто лактогенез I [1; 2; 34; 35]. На фоне повышения уровня пролактина от 10-20 нг/мл вне беременности до 200-400 нг/мл на поздних сроках беременности в лактогенез I происходит увеличение размеров и массы груди, эпителиальные клетки альвеол дифференцируются и созревают в секреторные клетки (лактоциты), способные синтезировать уникальные компоненты молока, такие как лактоза [1; 33; 35]. Для этого требуется наличие «лактогенного гормонального комплекса» – сочетание гормонов, стимулирующих и подавляющих лактацию, но при этом способствующих пролиферации и дифференцировки клеток молочной железы. В течение беременности производство молока подавляется высоким уровнем циркулирующего прогестерона у большинства млекопитающих, а также эстрогена у человека [2; 33; 36]. Ингибирующее действие прогестерона столь мощное, что после родов следующая стадия инициации лактации (секреторная активация) может задерживаться, если в матке остаются кусочки плаценты [37]. Пролактин и его синергисты (в частности глюкокортикоиды) действуют на соответствующие рецепторы, что стимулирует синтез грудного молока. Если у матери в этот период происходят роды (рождение недоношенного ребенка), то молоко уже может вырабатываться. Однако у беременных женщин процесс синтеза молока удерживают в неактивном состоянии ингибирующие гормоны (прогестерон, эстрогены), которые подавляют реакцию клеток-мишеней на пролактин. Соотношение активности стимулирующих и ингибирующих гормонов способствует выраженности появления молозива у беременной женщины. Сразу после родов и в течение последующих нескольких часов грудь реагирует на изменения гормонального фона и начало стимуляции сосанием ребенка, что приводит к выработке и выведению молока [2; 38; 39]. В период беременности полноценной выработки молока нет. Также отсутствует выброс окситоцина, которые мог бы выводить его из молочных протоков. Поэтому у беременных женщин (на сроке после 12-16 недель) появление молока, напоминающего молозиво, свидетельствует о том, что соединения между альвеолярными клетками неплотные. Промежутки между лактоцитами позволяют жидкостям и растворенным веществам перемещаться между молочными протоками и интерстициальным пространством молочной железы. Это, так называемый, парацеллюлярный путь образования молока. Концентрация лактозы в образующимся молоке имеет прямую корреляцию с концентрацией калия, а натрий и хлор обратно связан с уровнем лактозы [1; 2]. Попадая в молочные протоки, жидкость и растворенные вещества могут выделяться через сосок. Парацеллюлярный путь выделения молока/молозива в период беременности (с изменениями из Neville MC: Determinants of milk volume and composition в Jensen RG, editor: Handbook of milk composition, San Diego, 1995, Academic Press.). Секреторная активация – инициирование обильного выделения молока. Началом обильного производства молока после родов у всех млекопитающих является II этап лактогенеза или лактогенез II (со 2-3 по 8 день после родов), что нашло отражение в термине «молоко прибывает». В этот период объем молока быстро увеличивается с 38 по 98 час после родов и затем резко выравнивается. Не все женщины испытывают «приход молока» на 3-4 день после родов. У некоторых женщин в этот период отмечается избыточное образование молока, что иногда затрудняет прикладывание ребенка к груди. В первые 4 дня после родов уровень прогестерона снижается в десятки раз; быстро снижаются уровни эстрогена и плацентарного лактогена (после рождения плаценты) на фоне сохранения показателей пролактина, инсулина и кортизола. Прогестерон считается ключевым гормоном, тормозящим начало лактации. Снижение его уровня считается триггером для лактогенеза II [40–42]. Внутриклеточная регуляция в лактоците синтеза белка женского молока. (с изменениями по [2] из Mercier and Gaye: Chapter 7. In Mepham TB, editor: Biochemistry of lactation, New York, 1983, Elsevier). После родов отмечается резкое падение уровня прогесторона, что «снимает» блокирующий эффект. Пролактин выделяется передней долей гипофиза в пульсовом режиме от 7 до 20 раз в сутки с более высоким уровнем во время сна [40–42]. Такие пиковые повышения накладываются на постоянный уровень секреции. Все эти изменения гормонального фона инициируют лактогенез II, который сопровождается значительным снижением в грудном молоке уровней натрия, хлоридов, белка и увеличением лактозы и молочных жиров. Падение уровня прогестерона после удаления плаценты, совпадающее с увеличением синтеза лактозы, инициирует лактогенез II (с изменениями по [2] из Czan KC, Henderson JJ, Kent JC, et al: Hormonal control of the lactation cycle. In Hale TW, Hartmann PE, editors: Textbook of human lactation, Amarillo, Tex., 2007, Hale Publishing LP.). В период уже установившейся лактации прогестерон не подавляет выработку молока, поскольку в лактогенез III в клетках молочной железы отсутствуют рецепторы прогестерона [2; 36; 43]. Это связано с их особенностями – концентрация рецепторов прогестерона на клетку зависит от состояния развития молочной железы. Так они присутствуют до беременности и родов, уменьшаются во время беременности, не обнаруживаются во время лактации и вновь появляются во время лактационной инволюции [36; 44]. Кроме того, эстрогены, уровень которых значительно снижается сразу после родов, дополнительно уменьшают количество рецепторов прогестерона [36; 43]. Регуляция лактации пролактином (с изменениями по [2] из Mercier and Gaye: Chapter 7. In Mepham TB, editor: Biochemistry of lactation, New York, 1983, Elsevier). В период установившейся лактации основным гормоном выработки молока является пролактин. В этот период исчезают рецепторы прогестерона. Так же молочная железа во время лактации описана как «нечувствительная к эстрогенам» – эстрогены в этот период не вызывают пролиферации и дифференцировки клеток [45]. В лактирующей молочной железе присутствуют альфа-рецепторы и бета-рецепторы эстрогена [46]. Наиболее активные первые, вторые же в молочной железе несколько противодействуют гиперпролиферации клеток, индуцированной альфа-рецепторами [46]. Эстрогены усиливают действие пролактина на маммогенез, но противодействуют пролактину, ингибируя секрецию молока [2]. Вероятно, эти своеобразные механизмы защиты лактация от воздействия прогестерона и эстрогенов, созданные природой. Подробнее о других «гормонах лактации» можно прочитать в соответствующей литературе. Изменения клеточного метаболизма происходят в результате закрытия промежутков между альвеолярными клетками соединительными контактами (белками), при котором клетки плотно соединяются между собой [1; 2]. Это сопровождается изменением эпителия молочных желез для производства молока – уменьшается проницаемости парацеллюлярного пути (вплоть до полного закрытия), нарастает секреция защитных (например, лактоферрин, иммуноглобулины) и других компонентов молока параллельно увеличению производства лактозы [1; 2; 33]. В дальнейшем весь период лактации жидкость и вещества попадают в молочные протоки только трансцеллюлярным (через лактоциты) путем или синтезируются в лактоцитах. Трансцеллюлярный путь выделения молока в период лактации (с изменениями из Neville MC: Determinants of milk volume and composition в Jensen RG, editor: Handbook of milk composition, San Diego, 1995, Academic Press.). Трансцеллюлярный путь. Недооценка роли лактогенеза II приводит к задержке секреторной активации. Причин задержки лактогенеза II множество – первые роды, кесарево сечение, длительный II период родов, диабет I типа у матери, анальгезия в родах, ожирение, стресс, хирургические вмешательства на груди и т.д. [1]. Одним из маркеров надвигающихся проблем грудного вскармливания может быть высокий уровень натрия в грудном молоке на третий день после родов. В норме натрий быстро снижается с 60 до 20 ммоль/л к этому сроку при исключительно грудном вскармливании. Даже женщины, которые ежедневно сцеживают небольшое количество молока, имеют физиологическое снижение содержания натрия [47] и в [1; 2] Morton, 1994. Задержка лактогенеза II фактически означает задержку «запуска» всей лактации. В первые несколько дней секрет, выделяемый из молочных желез, состоит из желтоватой густой жидкости – молозива. Молозиво человека отличается от зрелого молока как по составу, так и по соотношению компонентов. В течение следующих 10-21 дней, состав молока переходит в зрелое молоко [1; 2]. Состав молозива, переходного и зрелого молока можно найти в соответствующей литературе. После инициации лактации весь последующий период кормления ребенка грудью основным гормоном, поддерживающим биосинтез молока, является пролактин. Выведение молока из лактоцитов и протоков осуществляется за счет действия окситоцина. Выведение окситоцином молока без пролактина не происходит [1]. Продолжение установившейся молочной секреции называется III этапом лактогенеза или лактогенез III (так же этот этап называется галактопоэзом), который начинается примерно с 3-8 дня после родов, длится весь период кормления грудью и заканчивается примерно через 30-40 дней после последнего кормления ребенка. При переходе II этапа лактогенеза в лактогенез III контроль лактации изменяется с эндокринного (управление гормонами) на аутокринный (управление удалением молока) (Prentice A et al., 1989). Этот вывод был сделан на основании того, что количество молозива, секретированного некормящими и кормящим женщинами в течение первых нескольких послеродовых дней, не отличалось, а в последующие дни количество молока резко уменьшалось у первых и увеличивалось у вторых. Кормление грудью для инициирования лактации не являлось ведущим фактором, но оно имело существенное значение для его продолжения уже после инициации [1; 41; 48]. Начало обильной секреции молока после рождения и «приход» молока произойдут несмотря на то, будет ли ребенок приложен в груди или нет, поскольку в этот период контроль выработки молока является эндокринным. [1]. А вот вся дальнейшая лактация зависит от объема молока, высосанного ребенком или сцеженного матерью из груди, поскольку аутокринный механизм регуляции зависит только от объема выведенного молока, но не от влияния гормонов. Пролактин лишь является основой процесса лактогенеза III. Грудь – это не пассивный контейнер с молоком, а орган активного производства. Удаление молока из груди поддерживает выработку молока; наоборот, отсутствие адекватного удаления молока или застой уменьшает синтез грудного молока в груди. Производство молока отражает аппетит младенца, а не способность женщины производить молоко [1; 41; 49]. Пока молоко удаляется регулярно из груди, альвеолярные клетки продолжают секретировать молоко почти бесконечно [1]. При увеличении выведения молока из груди увеличивается и его выработка, что объясняется аутокринным механизмом регуляции лактогенеза III. Этот феномен и есть «принцип спроса и предложения» [50]. Аутокринный механизм является регуляцией с обратной связью, которая контролирует продукцию молока в соответствии с потребностью младенца. «Чем больше мать кормит грудью, тем больше молока там будет» [51]. Поскольку кормление грудью является энергоемким процессом, то природой заложен целенаправленный смысл – должна быть гарантия отсутствия расточительного перепроизводства и наличия механизмов быстрой реакции на изменение потребности младенца [1]. Уровни пролактина и окситоцина регулируются гипофизом и гипоталамусом. Для поддержания лактации необходим базальный уровень пролактина, который усиливается его выбросами в результате сосания. Частота повышения уровня пролактина зависит от частоты и продолжительности прикладываний к груди. Под действием пролактина молоко синтезируется в лактоцитах, а окситоцин выводит его в молочные протоки, которые открываются на соске. Когда молоко не удаляется из лактоцитов или протоков, повышенное давление уменьшает капиллярный кровоток. Снижение кровотока уменьшает поступление окситоцина к миоэпителиальным клеткам, в связи с чем снижается выведение молока. Отсутствие выведения молока приводит к прекращению выделения пролактина из гипофиза [1; 2; 41]. Уровень пролактина в плазме наиболее повышен в раннем послеродовом периоде и напрямую зависит от частоты, интенсивности и длительности стимуляции сосков [1]. Концентрация пролактина в крови удваивается в ответ на сосание и достигает своего пика приблизительно через 45 минут после начала кормления грудью [52]. Через 6 месяцев после родов, в сыворотке крови могут быть выбросы пролактина, которые более чем в два раза выше базового уровня в ответ на сосание [53]. Если мать не кормит грудью, уровень пролактина обычно достигают небеременного через 7 дней после родов [35]. Интересно то, что при местной анестезии сосков, при которой уменьшаются ощущения, уровень пролактина не увеличивается [3]. Нормальный уровень пролактина у некормящих женщин 20 и менее нг/мл. У кормящих женщин средний исходный уровень составляет 60-110 нг/мл с 10 дня после родов; потом этот уровень снижается, но остается повышенным в течение первого полугодия после родов (в среднем 50 нг/мл). У лактирующих женщин с аменореей базовый уровень пролактина выше (примерно до110 нг/мл) по сравнению с женщинами, у которых восстановился менструальный цикл раньше 180 дня после родов (примерно 70 нг/мл) [1; 2; 53]. Уровни пролактина [1; 2] Пролактин присутствует в грудном молоке в концентрации ниже, чем в плазме крови [1]. Внутриальвеолярное высвобождение пролактина играет важную роль в установлении и поддержании лактации [1]. Уровень пролактина молока примерно одинаков между в правой и левой грудью и наиболее высокий в первой половине дня [54]. В период лактации для уровня пролактина в крови матери характерно следующее [1]: Источник [1] по Love, 1990 [61] с изменениями. Чувствительные окончания, расположенные в основном в ареолах и сосках, стимулируются сосанием. Импульсы по нервным путям попадают в головной мозг и вызывают секрецию и высвобождение пролактина и окситоцина, которые вызывают секрецию и выделение молока соответственно. Стимуляция ребенком ареолы и соска матери представляет собой классический нейроэндокринный рефлекс. Хотя высвобождение окситоцина и пролактина усиливается при стимуляции этой области, часть окситоцина вырабатывается в ответ на раздражение других сенсорных путей – зрительный, осязательный, обонятельный и слуховой [41; 62]. У матери может выделяться молоко при мыслях о ребенке, при его виде, касании, осязании или обонянии. Однако пролактин выделяется только при стимуляции соска. Поэтому выработка молока не инициируется другими сенсорными путями. Окситоцин также выделяется при болях, физических упражнениях, холоде, тепле, изменении осмоляльности плазмы или гиповолемии, но эти реакции притупляются или реверсируются во время лактации [63; 64]. Окситоцин при сосании ребенком груди вызывает выброс молока из альвеол в молочные протоки – это рефлекс выброса или выведения молока. Более подробно про влияние на лактацию различных гормонов вы можете прочитать в [1; 2].
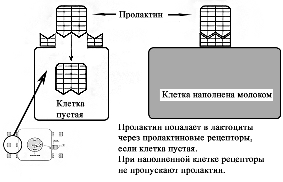
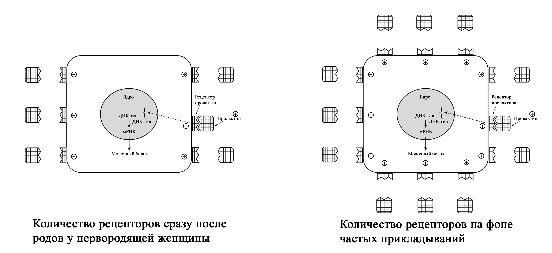
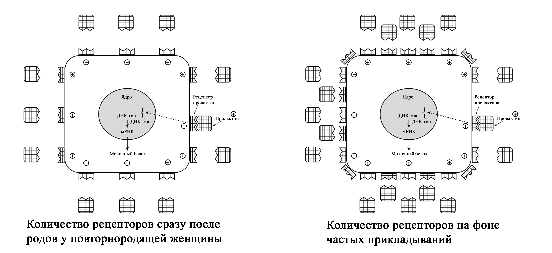
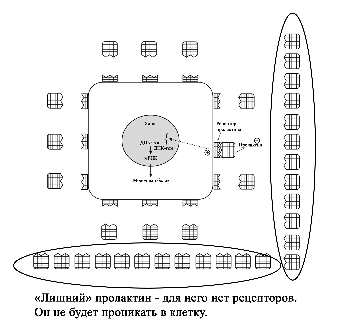
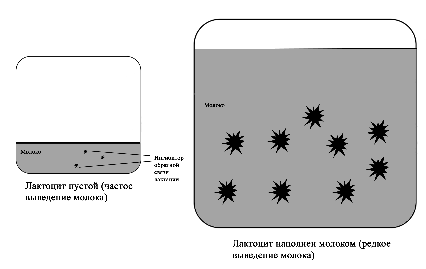
Регуляция лактации пролактином. Пролактин является важным гормоном в период лактации. Большая часть пролактина синтезируется и секретируется в передней доле гипофиза [2]. У мужчин и женщин базовые уровни пролактина одинаковы. Отмечается повышение уровня пролактина во время сна [2]. У лактирующих женщин он также повышается (пики до 30-50 кратного уровня) через 30-45 минут после стимуляции ареолы и соска [2; 41]. Регуляция лактации пролактином осуществляется через пролактиновые рецепторы, которые находятся на поверхности лактоцитов. Эти рецепторы пропускают в клетку пролактин, который стимулирует выработку молока. При наполнении лактоцита молоком клеточная стенка растягивается и рецепторы закрываются, что блокирует попадание пролактина внутрь. Соответственно синтез молока прекращается. Как только клетка опорожняется в молочные протоки под действием окситоцина, рецепторы вновь открываются и начинаются пропускать пролактин внутрь для синтеза молока [2]. Этот цикл образования молока осуществляется в течение всего периода лактогенеза III. De Carvalho et al. (1983) предположил, что частое кормление в период ранней лактации стимулирует более быстрое увеличение объема выработки молока потому, что сосание стимулирует развитие рецепторов пролактина в молочной железе. Согласно этой теории, число рецепторов на клетку увеличивается в период ранней лактации и остается постоянным после этого [1; 65–67]. Увеличение количества рецепторов позволяет большему количеству пролактина попасть в лактоциты, что увеличивает выработку молока. Увеличение количества пролактиновых рецепторов при частых кормлениях у первородящих женщин (с изменениями из Mercier and Gaye: Chapter 7. In Mepham TB, editor: Biochemistry of lactation, New York, 1983, Else-vier). Zuppa et al. (1988) в своем исследовании показали, что в течение первых 4 дней после родов у повторнородящих женщин при более низком уровне пролактина в крови по сравнению с первородящими, объем молока был значительно выше. Исследователи пришли к выводу, что у повторнородящих женщин в молочной железе было больше пролактиновых рецепторов, который остались после предыдущих родов [1; 68]. Увеличение количества пролактиновых рецепторов при частых корм-лениях у повторнородящих женщин (с изменениями из Mercier and Gaye: Chapter 7. In Mepham TB, editor: Biochemistry of lactation, New York, 1983, Elsevier). Контролирующим фактором выхода грудного молока является число рецепторов пролактина, а не количество пролактина в сыворотке крови [1; 68]. Определенное количество рецепторов может пропустить в клетку соответствующее количество пролактина. Бессмысленно в этом случае увеличивать количество пролактина в крови матери, поскольку ограниченное количество рецепторов не может пропустить в клетку больший объем гормона. Увеличение же количества рецепторов позволяет большему количеству пролактина попасть в клетку. Тем самым это увеличивает производство молока даже при низком уровне пролактина, но который соответствует количеству рецепторов. Это открытие помогает объяснить, почему младенцы повторнородящих матерей начинают прибавлять в весе несколько быстрее, чем у первородящих [1; 68]. Избыток пролактина без соответствующего увеличения рецепторов бесполезен (с изменениями из Mercier and Gaye: Chapter 7. In Mepham TB, editor: Biochemistry of lactation, New York, 1983, Elsevier).
Регуляция лактации пролактин-ингибирующим фактором (англ. prolactin-inhibiting factor или PIF). Несмотря на то, что пролактин вырабатывается в гипофизе, особенностью его является отсутствие регуляции по «принципу обратной связи», как это происходит для других гормонов. То есть в организме нет вещества, в ответ на повышение уровня которого снижался бы пролактин. Сдерживающим (тормозящим) эффектом обладает пролактин-ингибирующий фактор (или по другим авторам гормон), вырабатываемый в гипоталамусе. В свою очередь выработку этого фактора регулируют катехоламины, в том числе и дофамин. При повышении уровня дофамина увеличивается количество пролактин-ингибирующего фактора, что в свою очередь приводит к подавлению выработки пролактина. И наоборот – при снижении уровня первого, снижается уровень пролактин-ингибирующего фактора, и увеличивается выработка пролактина. Дофамин, действуя непосредственно на гипофиз, так же уменьшает секрецию пролактина [1; 2; 15; 41; 69]. При том, что дофамин напрямую и опосредованно негативно влияет на выработку пролактина, он играет важную роль в регуляции выработки последнего. Дофамин необходим для снижения пролактина сразу после кормления и в периоды между прикладываниями к груди. За счет этого не происходят постоянные выбросы и нарастания пролактина в крови. В исследовании было показано, что при разделении пары мать-ребенок в течение 24 часов отмечается значительно нарастание дофамина, что приводит к подавлению выработки пролактина [70; 71]. В том числе и этим объясняется снижение лактации у кормящих женщин при редких прикладываниях ребенка. Стимуляция сосков и удаление молока из груди подавляют выработку пролактин-ингибирующего фактора и дофамина. Это вызывает повышение уровня пролактина, что способствуют выработке молоко в молочной железе. Препараты, которые используют для подавления лактации (бромокриптин, каберголин и т.д.), действующие аналогично пролактин-ингибирующему фактору – их воздействие на рецепторы усиливает выделение дофамина. Наоборот домперидон, метоклопрамид, фенотиазины и производные резерпина увеличивают выработку молока за счет подавления выработки пролактин-ингибирующего фактора – они блокируют дофаминовые рецепторы [1; 2; 72–74].
Регуляция лактации ингибитором обратной связи лактации (англ. feedback inhibitor of lactation или FIL). Кроме блокирования пролактина на уровне рецепторов и снижения лактации при переполнении лактоцитов молоком за счет уменьшении капиллярного кровотока существует еще один локальный механизм регуляции лактации. При отсутствии выведения молока из груди в лактоцитах накапливается белок, которые идентифицирован как ингибитор обратной связи лактации. Этот белок обладает локальным подавляющим лактацию эффектом [1; 2]. Фактически он всегда находится в молоке. При частом выведении молока из груди концентрация этого белка не увеличивается и не вызывает подавления лактации. Если молоко не удаляется, ингибитор обратной связи накапливается и ограничивает секрецию молока в лактоцитах. Это позволяет защитить грудь от переполнения молоком. Если вновь начать выводить молоко, секреция молока восстановится. Однако период переполнения груди не должен быть длительным, так как в течение суток начинают включаться другие механизмы подавления лактации: нарастает уровень дофамина, стимулируется выброс пролактин-ингибирующего фактора, блокируются пролакти-новые рецепторы в переполненных лактоцитах. Разный объем правой и левой груди у некоторых женщин, кормящих ребенка чаще с одной стороны, связан с действием ингибитора обратной связи – происходит местное снижение выработки молока при более редком выведении из меньшей по объему груди [2; 75]. Поскольку в лактогенезе III регуляция лактации происходит только по аутокринному механизму («принцип спроса и предложения»), то ингибитор обратной связи вместе с другими факторами позволяет организму матери вырабатывать столько молока, сколько необходимо ребенку [2; 75].
Постлактационная регрессия (инволюция) молочных желез [2]. Прекращение выработки молока связано с быстрым или медленным уменьшением выведения его из груди. Это связано с несколькими механизмами [2]: Растяжение лактоцитов приводит повреждению эпителия и постепенному разрушению альвеол, что также уменьшает количество молока. Содержимое протоков (молоко, секрет, разрушенные клетки и пр.) всасываются окружающими тканями. Разрушающиеся альвеолы постепенно замещаются жировой и соединительной тканями, и элементы возвращаются в состояние покоя. Однако полностью железа не возвращается в долактационное состояние. В первые дни отлучения повышаются аутофагические процессы (от греческих слов «Авто»=само- и «phagein»=«поглощать»). Железа подвергается апоптозу альвеолярного эпителия и ремоделированию, возвращаясь к добеременному состоянию [2]. Медленное отлучение (обычно в течение 3 месяцев) значительно отличается от резкого по скорости и интенсивности инволюции. В конце этого процесса структура и морфология тканей не возвращается к той, которая была до беременности [2]. Часть лактоцитов не подвергаются инволюции и остаются в качестве «клеток-предшественников памяти» в следующую беременность [2]. В период отлучения в грудном молоке отмечается значительно увеличение концентрации белка, натрия и хлоридов. При этом концентрация лактозы снижается только при снижении объема вырабатываемого молока менее 400 мл в день. Глюкоза и магний не изменяются. На всех стадиях лактации нормальный показатели для натрия 3-18 ммоль/л, хлоридов 8-24 ммоль/л, белка 8-23 г/л, лактозы 140-230 ммоль/л. Изменения этих показателей вне данного диапазона предполагает наличие мастита или периода отлучения. При постепенном отлучении в период с 6 до 15 месяцев жизни ребенка уровни глюкозы, фосфатов и кальция снижается, а уровни липидов, калия и магния повышаются [2]. Постлактационная инволюция молочной железы характеризуется двумя различными физиологическими процессами (фазами) [42; 76]. Первая фаза – секреторные эпителиальные клетки подвергаются апоптозу и запрограммированной гибели. Индуктором апоптоза является накопление молоко в лактоцитах [76]. Вторая фаза – базальная мембрана молочной железы подвергается разрушению ферментами, происходит ремоделирование тканей [30; 42; 76]. Апоптоз почти отсутствует во время лактации, но развивается в течение 2 дней инволюции. В начальной фазе инволюции апоптоз полностью дифференцированных эпителиальных клеток молочной железы происходит без видимой деградации внеклеточной структуры. Вторая фаза состоит из внеклеточного ремоделирования и измененнения мезенхимально-эпителиальных взаимодействий с последующим апоптозом клеток, которые больше не дифференцируются [76; 77]. Во время постлактационной инволюции молочной железы большая часть эпителия молочной железы погибает и реабсорбируется. [2]. В ситуациях принудительного отлучения происходят две фазы. Начальная апоптотическая фаза начинается в течение 12 часов и сохраняется около 72 часов. За это время молоко накапливается в альвеолярном просвете, а уровень лактогенных гормонов снижается. Первая фаза инволюции перед апоптозом является обратимой, и лактация может быть восстановлена в течение 2 дней. Вторая фаза включает в себя дальнейший апоптоз, деградацию матрикса и ремоделирование железы. Старая соединительная ткань и базальная мембрана удаляются, затем преобразуется протоковый компонент. Апоптоз продолжается на этом этапе [30; 78]. Вторая фаза инволюции является необратимой. | |
| Просмотров: 34254 | | |

![Стадии лактации [1; 2].](/Articles/MyThoughts/Fiziol/Stad_thumb.gif)